Reakční kinetika (2/19) · 9:14
Rychlost reakce Jak můžeme definovat rychlost reakce? Příklady výpočtu průměrné rychlosti reakce.
Rychlost chemické reakce je definována jako změna koncentrace reaktantu nebo produktu s časem. Koncentrace je v molech na litr, někdy se značí "M", a čas je v sekundách. Takže rychlost chemické reakce vyjádřujeme v (molech na litr) za sekundu. (Moly na litr) za sekundu zní hodně jako metry za sekundu, a to, pokud si něco pamatujete z fyziky je jednotka rychlosti. Průměrná rychlost je rovna změně v 'x' lomeno změnou času. Když si to propojíme s tímto, již známým vzorečkem, pomůže vám to pochopit definici pro rychlost reakce v chemii. Zkusme to vztáhnout k nějaké velmi jednoduché reakci. Máme jeden reaktant, A, měnící se do jednoho produktu, B. No a teď si řekněme, že čas je roven nule. Začínáme s 1,00 molární koncentrací A. A se ještě nestihlo přeměnit v B. Takže, když je čas roven 0 koncentrace B je 0. Řekněme, že počkáme 2 sekundy. Počkáme 2 sekundy a pak změříme koncentraci A Je jasné, že koncentrace A půjdu dolů, protože A se bude měnit v B Řekněme, že koncentrace A bude 0,98 molární. Takže jsme ztratili 0,02 M z koncentrace A, a vzhledem k tomu, že A se mění v B po 2 sekundách, tak koncentrace B je 0,02 M. Jasně, protože A se změnilo v B. Tak a to je tedy koncentrace B po 2 sekundách. Jestli chci znát průměrnou rychlost reakce, musíme se podívat na naši definici pro rychlost reakce. Změna v koncentraci Udělejme změnu v koncentraci našeho produktu lomeno změnou času. Takže, rychlost reakce je rovna změně v koncentraci produktu. To je konečná minus počáteční koncentrace. Takže konečná koncentrace je 0,02 M. Takže, si tu napíšeme 0,02 M, a z toho odečteme počáteční koncentraci produktu, která je nulová. Takže 0,02 minus 0, to je vlastně celé lomeno změnou času. To je konečný čas minus čas počáteční, a to je 2 minus 0. Takže rychlost reakce, průměrná rychlost reakce, je rovna 0,02 děleno 2, což je 0,01 (molů na litr) za sekundu. Tak to je naše průměrná rychlost reakce Od času 0 do času, který je roven 2 sekundám. Můžeme udělat tu samou věc pro A. Teď jsme rychlost reakce definovali jako rychlost vzniku látky B. Ale můžeme jí definovat stejně dobře podle rychlosti úbytku látky A. Tak, aby rychlost byla rovna, změně v koncentraci A, to je konečná koncentrace A, která je 0,98 molární, minus počáteční koncentrace A, Počáteční koncentrace byla 1 molární. Takže 0,98 minus 1,00, a to celé lomeno konečným minus počátečním časem, takže ve vzorci nad 2 minus 0. To by nám dávalo -0,02. -0,02 tady, lomeno 2. To by nám dalo zápornou hodnotu reakční rychlosti. Ale v chemii je rychlost reakce definována jako kladná veličina. Takže potřebujeme záporné znaménko. Potřebujeme ho sem dát, protože nám dává kladnou hodnotu pro rychlost. Tak, teď dostaneme 0,02 děleno 2, což je 0,01 (molů na litr) za sekundu. Takže dostaneme kladnou hodnotu pro rychlost reakce Tak jo, teď jsme vypočítali průměrnou rychlost reakce, s využitím zániku látky A za současného vzniku B, Teď bychom to mohli udělat obecnější Mohli bychom říct, že naše rychlost reakce je rovna... ...to by byla změna v koncentraci A lomeno změnou času. Ale musíme do vzorce přidat i záporné znaménko. Dáváme tam záporné znaménko, abychom dostali kladnou hodnotu rychlosti. Takže rychlost je rovna záporné změně v koncentraci A lomeno změnou času. A to je rovno, změně v koncentraci B lomeno změnou času. Tady ani nepotřebujeme záporné znaménko, protože už ve výpočtu jsme viděli, že dostáváme kladnou hodnotu pro rychlost. Tak to jsou dva způsoby, jak vyjádřit rychlost této reakce. Takže zde jsem to napsal trochu obecněji. Podíváme se ještě na komplikovanější reakci Tady máme vyváženou rovnici pro rozpad oxidu dusičného na oxid dusičitý a kyslík. Řekněme, že kyslík vzniká rychlostí 9 krát 10 na minus 6 (molů na litr) za sekundu. Takže co je vlastně rychlost vzniku oxidu dusičitého? No, pokud se podíváte na vyváženou rovnici, pro každý jeden vytvořený mol kyslíku se vytvoří 4 moly oxidu dusičitého. Takže akorát musíme vynásobit rychlost formace kyslíku čtyřmi. To nám dává 3,6 krát 10 na minus 5 (molů na litr) za sekundu. Takže, oxid dusičitý vzniká 4 krát rychleji než kyslík. No a co oxid dusičný? Takže, N₂O₅. Podívejte se na stechiometrické poměry. Pro vytvoření každého jednoho molu kyslíku ztrácíme 2 moly oxidu dusičného. Takže pokud začneme s rychlostí tvorby kyslíku, protože je tu poměr 1 ku 2, musíme to vynásobit dvěma, a protože ztrácíme oxid dusičný, dáme sem záporné znaménko. Takže to nám dává -1.8 krát 10 na minus 5 (mol na litr) za sekundu. Takže oxid dusičný mizí dvakrát rychleji než se vytváří kyslík. Zamysleme se teď nad rychlostí reakce. Takže rychlost naší reakce je rovna... ...můžeme prostě říct, že je rovna vzniku kyslíku, ne? Můžeme říct, že je rovna 9 krát 10 na -6 (molů na litr) za sekundu. Napíšu to sem dolů. Rychlost je rovna změně koncentrace kyslíku lomeno změnou času. Co kdybychom to chtěli vyjádřit s ohledem na vznik oxidu dusičitého? Rychlost vzniku oxidu dusičitého byla 3,6 krát 10 na minus 5. Pojďme se zamyslet nad tím, co potřebuji na vynásobení tohoto čísla, abych dostal toto číslo? Protože toto číslo je 4 krát větší než to na levé straně, potřebuji ho vynásobit jednou čtvrtinou. Takže tady dole, pokud mluvíme o změně koncentrace oxidu dusičitého lomeno změnou času, abychom dostali stejnou rychlost, museli bychom to vynásobit jednou čtvrtinou. To bychom měli, a teď se konečně pojďme zamyslet nad oxidem dusičným. Takže, řekli jsme, že ten mizel rychlostí -1.8 krát 10 na minus 5. Takže ještě jednou, co potřebuji na vynásobení tohoto čísla, abych dostal 9,0 krát 10 na minus 6? No, toto číslo s ohledem na rozsah bylo dvakrát toto číslo takže ho musím vynásobit jednou polovinou. Musím se zbavit záporu, protože rychlosti reakcí jsou definovány jako kladné číslo. Takže tady potřebuji zápor. Takže to by mi dalo 9,0 krát 10 na minus 6. Takže na to, abych vyjádřil rychlost s ohledem na mizení oxidu dusičného, napsal bych změnu u N₂... ...to by byla změnu u N₂O₅ lomeno změnou času. Musím sem také přidat i zápornou jednu polovinu. Tak už jsme přišli na to, jak vyjádřit rychlost reakce, kterou máme zadanou pomocí vyčíslené rovnice. Takže, tady jsme měli dvojku pro oxid dusičný, a všimněte si, kam ta dvojka půjde pro vyjádření naší rychlosti. Pro oxid dusičitý byl koeficient roven 4. Takže, ta čtyřka půjde sem, a pro kyslík, pro kyslík... ...použiji zelenou... ...jsme měli jedničku. Takže jsem mohl napsat 1 přes 1, jen abych vám ukázal vzor, jak vyjádřit rychlost chemické reakce.
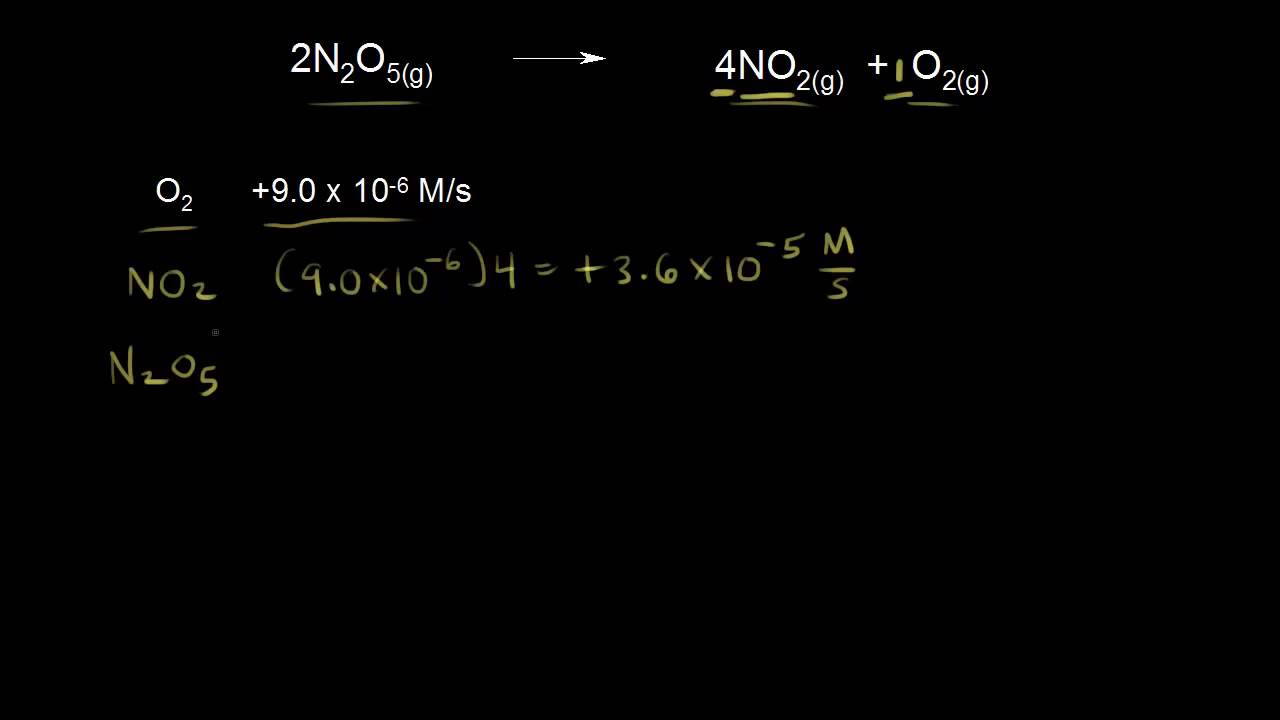
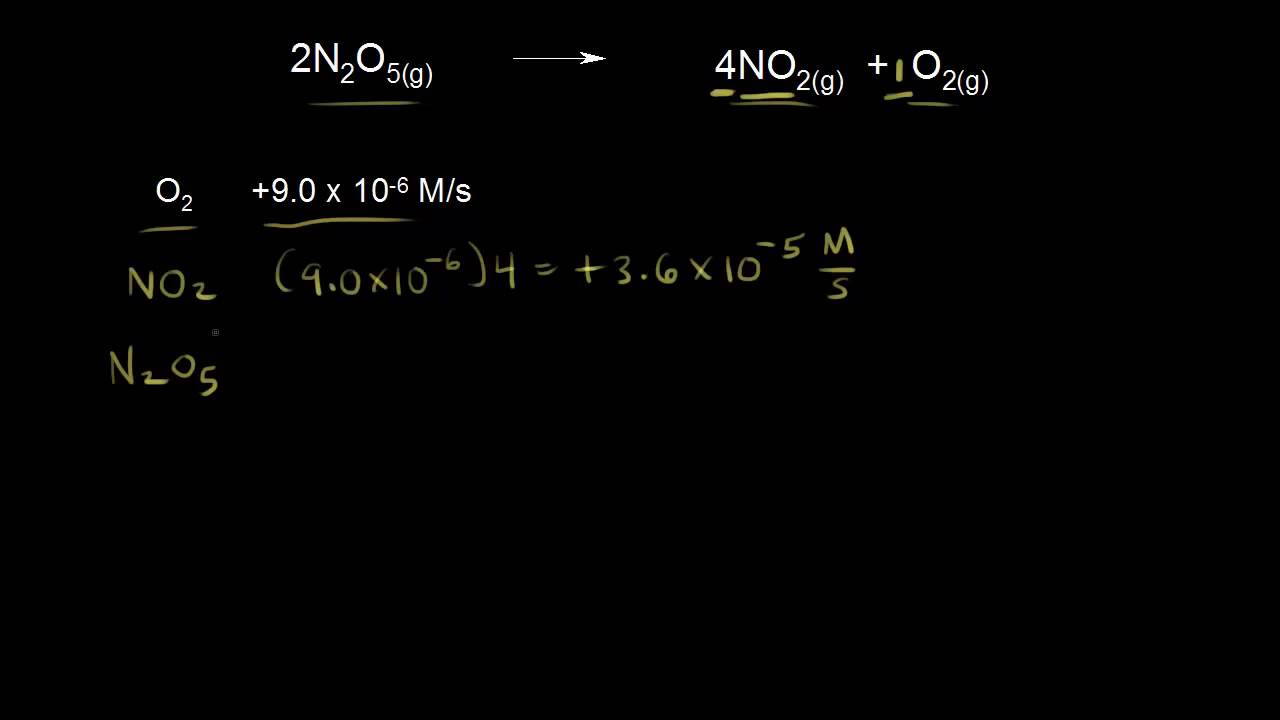
0:00
9:14