Reakční kinetika (19/19) · 7:30
Katalyzátory Na příkladu konkrétní reakce si ukážeme, co je to katalyzátor a jak funguje.
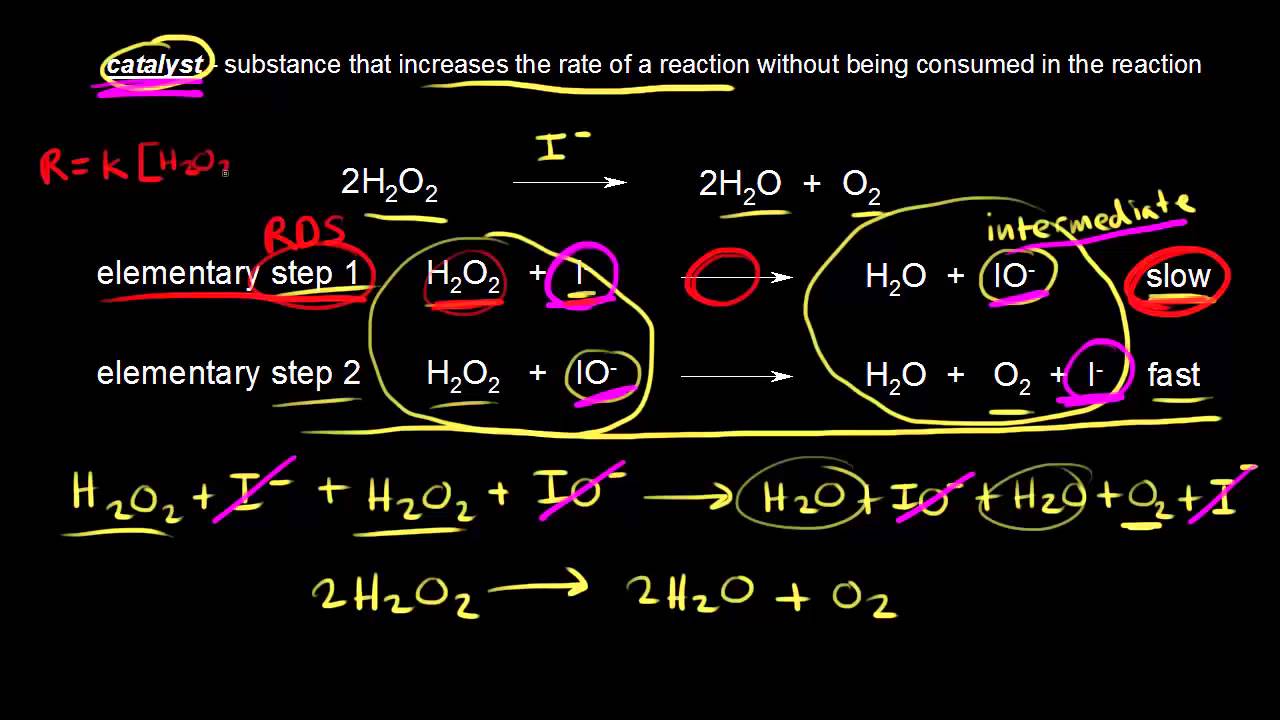
Katalyzátor je látka, která ovlivňuje rychlost reakce, ale sama se v reakce nemění. Podívejme se na rozklad peroxidu vodíku, H₂O₂, Jeho rozkladem získáte vodu a kyslík. Reakce probíhá za pokojové teploty. Bohužel je to velice pomalá reakce. Abychom ji urychlili, potřebujeme katalyzátor. Když děláte ukázku této chemické reakce, například známou sloní pastu, potřebujete přidat ionty jódu. Je to jeden z katalyzátorů, který můžete použít. Můžete použít jodid draselný, nebo jodid sodný. Přidáte tedy zdroj aniontů jódu, a reakce se urychlí. Takže anionty jódu jsou katalyzátorem. Zvyšují rychlost reakce. Podívejme se na mechanismus této reakce, když přidáme anionty jódu jako katalyzátor. V prvním kroku, máme H₂O₂ a jód jako katalyzátor. Vznikne jodnanový iont. Jodnanový iont je tedy náš meziprodukt. Dále víme, že první krok této reakce je pomalý. V druhém kroku reakce máme další molekulu peroxidu vodíku, která reaguje s naším jodnanovým aniontem, a vznikne nám kyslík. Tento krok je rychlý. Pamatujte si, že mechanismus reakce se musí skládat z elementárních kroků, které ve finále dají souhrnnou reakci. Takže když spojíme tyto dva kroky, měli bychom dostat celkovou reakci. Zapíšeme všechny reaktanty dohromady, tedy H₂O₂ a I⁻ a další H₂O₂ a IO⁻. A to nám dá produkty reakce. Zakroužkuju je zde. Máme H₂O a IO⁻ a další H₂O plus O₂, a také I⁻. Máme toho zde moc, podívejme se, co bychom mohli vykrátit. Co máme na obou stranách? Můžeme vykrátit jodid, jeden nalevo, druhý vpravo. To je náš katalyzátor. Zvyšuje rychlost reakce, ale není nijak spotřebováván. Používáme ho v prvním kroku, ale ve druhém kroku je jodidový aniont regenerován. Katalyzátor tedy není spotřebováván. Pak zde máme meziprodukt. Jodnanový iont nalevo a také napravo, můžeme ho vykrátit. Tento meziprodukt je tvořen v prvním kroku reakce, ale je spotřebován ve druhém kroku. Takže, co nám zde zbylo? Máme tu dvakrát H₂O₂ na straně reaktantů, a na pravé straně máme dvakrát H₂O, tedy dvě vody. A také kyslík, takže plus O₂. Takže dostaneme původní reakci, souhrnnou reakci. Tento mechanismus také musí odpovídat experimentálnímu rychlostnímu zákonu, který jsme si ukazovali v předchozích videích. Abychom mohli napsat rychlostní zákon, musíme odhalit krok, který určuje rychlost tohoto mechanismu, a v tomto mechanismu je první krok ten pomalejší. První krok tedy určuje rychlost reakce. Můžeme zapsat rychlostní zákon pomocí prvního kroku reakce. Což je tato jednoduchá reakce. Je to jednoduchá, bimolekulární reakce. Zapišme tedy rychlostní zákon. Rychlost reakce je tedy rovna rychlostní konstantě 'k', ať už je jakákoliv, krát koncentrace H₂O₂. Musíme násobit koncentrací H₂O₂, a protože zde máme koeficient roven jedné, pro elementární reakce, můžeme tento koeficient použít jako exponent. Máme tedy první mocninu. Dále také máme koncentraci jodidových aniontů, takže koncentrace I⁻, a náš koeficient je zde také jedna, a protože je to elementární reakce, náš koeficient bude tedy mocnitel. Toto je rychlostní zákon, určený podle určujícího kroku reakce, což je v souladu s experimentálním rychlostním zákonem pro naši souhrnnou reakci. Takže tento mechanismus je možný pro rozklad peroxidu vodíku. Jak vlastně náš katalyzátor zvýšil rychlost reakce? Podívejme se na energetický profil naší reakce bez katalyzátoru, tedy přeměna peroxidu vodíku na vodu a kyslík. Zde je verze bez katalyzátoru. Začínáme s určitou energií našich reaktantů, a víme, že zde nahoře máme energii tranzitního stavu. A rozdíl těchto dvou bude naše aktivační energie. Toto je naše aktivační energie naší reakce bez katalyzátoru. Když přidáme zdroj jodidových aniontů, tedy přidáme katalyzátor, nastane odlišný mechanismus, mechanismus s nižší energií, a víme, že tento mechanismus má dva kroky, takže si je nakreslíme. Energie reaktantů je stejná, ale my snížíme aktivační energii. Nakreslím to zde. Bude to vypadat asi takto. Vím, že nejsem skvělý malíř... Takto vypadá náš energetický profil, když přidáme katalyzátor. Toto bude přechodný stav, pro první krok našeho mechanismu. Aktivační energie se snížila, máme nižší aktivační energii. Z minulých videí si pamatujete, že když snížíte aktivační energii, zvýšíte rychlost reakce. Což popisuje Arrheniova rovnice. Takže toto přesně dělá katalyzátor, a když dosáhneme tohoto bodu, toto údolíčko, to je energie intermediátu, jodnanového iontu, a pak zde máme druhou aktivační energii, pro druhý krok našeho mechanismu. Toto je tedy první krok, napíšu Ea₁, a tohle bude aktivační energie druhého kroku. Tedy Ea₂. Aktivační energie prvního kroku je vyšší, protože to je náš určující krok rychlosti reakce. Opakuji, že katalyzátor neovlivňuje energii reaktantů nebo produktů. Ta zůstává stále stejná. Katalyzátor snižuje nezbytnou aktivační energii, což zrychluje rychlost reakce.

0:00
7:30