Předmět
Obsah dostupný na české Khan Academy
Obsah dostupný na české Khan Academy
Obsah dostupný na české Khan Academy
Obecná chemie
—
Chemie je všude,
Opakování základů chemie,
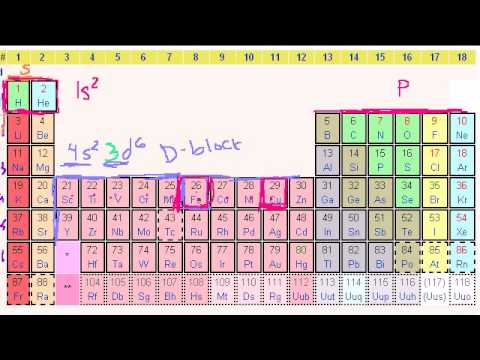
Stavba atomu, prvky, izotopy a periodický zákon,
Molekuly, ionty a chemické vazby,
Interakce molekul a vlastnosti látek,
Chemické reakce a stechiometrie
Organická chemie
—
Struktura a vazby,
Rezonance a teorie kyselin a zásad,
Alkany, cykloalkany a funkční skupiny,
Stereochemie,
Substituční a eliminační reakce,
Alkeny a alkyny,
Alkoholy, ethery, epoxidy a sulfidy,
Konjugované vazby a pericyklické reakce,
a další …
Obsah dostupný na české Khan Academy
Obsah dostupný na české Khan Academy
Rychlokurz světových dějin
—
První civilizace,
Počátky naší kultury,
A co na to Bůh?,
Dobývání a obchod,
Renesance, kolonialismus a obchod s otroky,
Revoluce a moderní společnost,
Nacionalismus, imperialismus a globalizace
Obsah dostupný na české Khan Academy