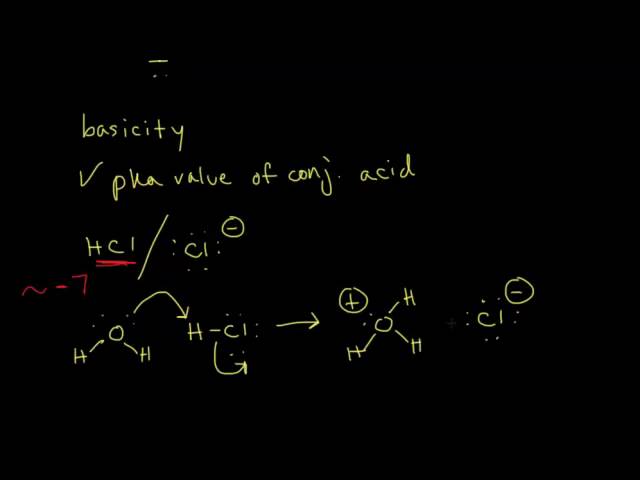Halogenuhlovodíky, substituční a eliminační reakce (2/15) · 13:00
Nukleofilita a bazicita Jak poznáme, zda je látka dobrý nukleofil nebo dobrá báze? Některé látky mohou být obojí, jiné jsou zase dobré pouze v jednom. Určení těchto vlastností pak bude klíčové pro substituční a eliminační reakce.
Navazuje na
Stereochemii.
0:00
13:00