Pufry a titrace (13/17) · 14:58
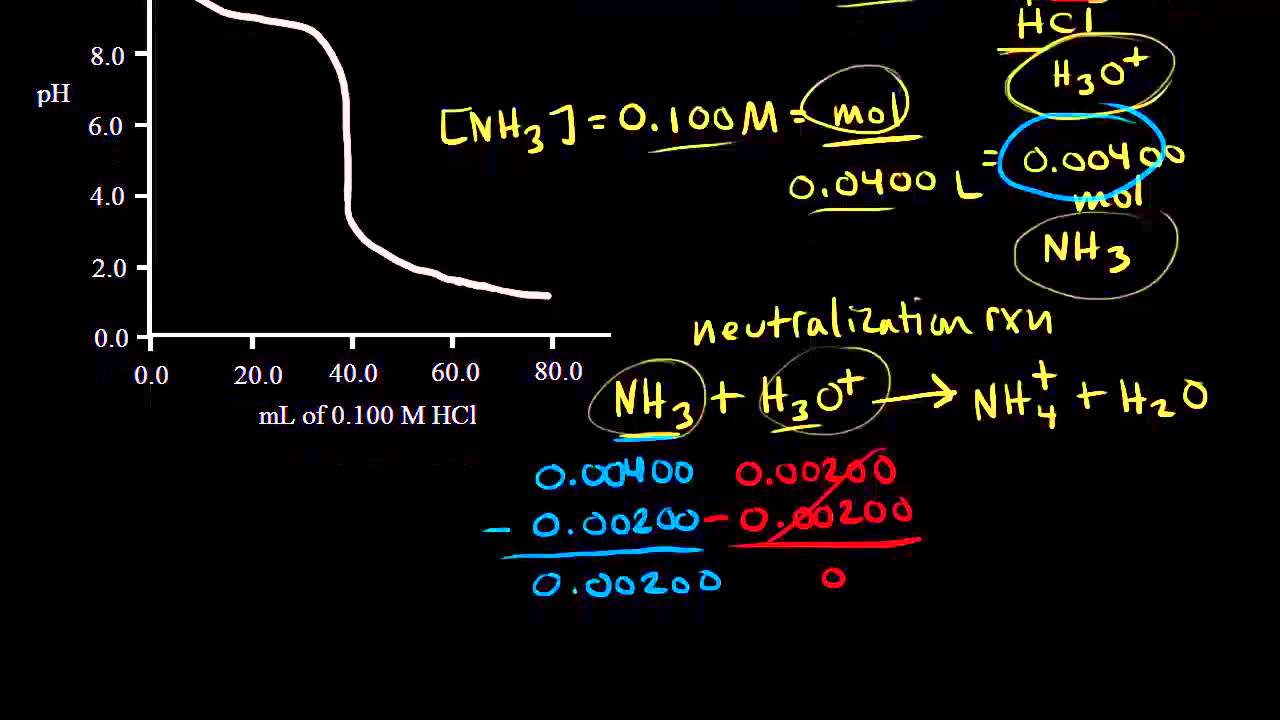
Titrace slabé zásady silnou kyselinou 1 V této sérii dvou videí si ukážeme a vypočítáme titrační křivku pro titraci slabé zásady silnou kyselinou. V první části si ukážeme, jak vypočítat pH před přidáním kyseliny a v bodě poloviční ekvivalence.
Navazuje na
Kyseliny a zásady.
0:00
14:58