Reakční kinetika (15/19) · 8:48
Srážková teorie Aby došlo k reakci musí dojít k takzvané účinné srážce. Co to vlastně je ta účinná srážka a další pojmy s tím spojené se dozvíme ve videu.
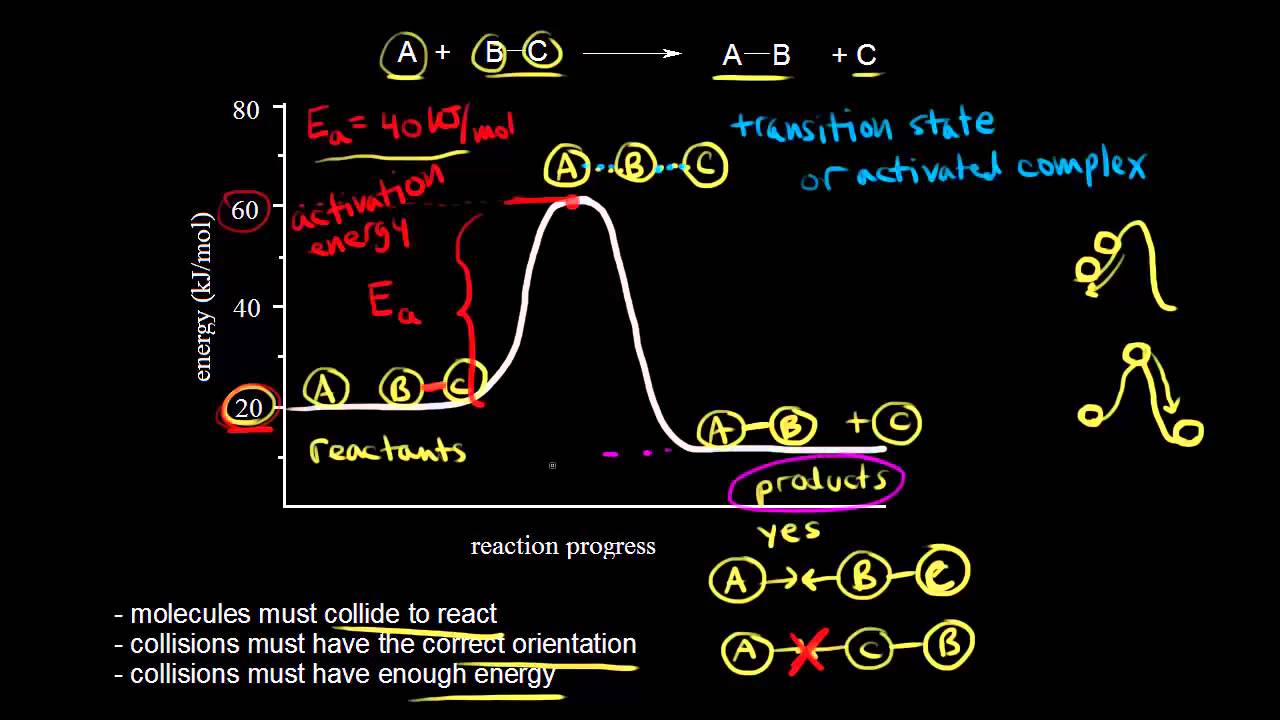
Abychom se mohli bavit o srážkové teorii uvažujme následující reakci. Máme zde atom A, který reaguje s dvouatomovou molekulou B-C za vzniku nové dvouatomové molekuly A-B a atomu C. Podle srážkové teorie se molekuly musí srazit, aby mohly zreagovat. Takže v tomto případě se musí atom A srazit s molekulou B-C, aby reakce nastala. Srážka musí dále být vhodně prostorově orientována, aby byla efektivní. Řekněme například, že v této reakci máme molekulu B-C. Naše molekula B-C se přibližuje k A orientována takto a jelikož chceme vytvořit vazbu mezi A a B, je tato orientace správná. Toto je způsob, kterým srážka musí proběhnout, aby se zahájila reakce. Pokud se dvouatomová molekula B-C přibližuje opačně orientována, tak, že máme atom A zde a C-B orientováno tak, že k atomu A je natočen atom C, pak toto není vhodná orientace pro započetí reakce. Takže toto by nefungovalo. Je tedy nutná srážka, ale srážka musí být také vhodně orientována. Nakonec je ještě nutno, aby srážka měla dostatečnou energii. Pokud srážka nemá dostatečnou energii, tak molekuly, nebo v tomto případě atom a molekula, se od sebe jen odrazí. Pokud máme dostatek energie, pak srážející se molekuly budou vibrovat dostatečně na to, aby rozbily vazby. Pojďme to tedy nakreslit. Naše reaktanty mají na počátku jistou energii. Takže tady si nakreslíme energii našich reaktantů. V tuto chvíli máme atom A a molekulu B-C a řekněme, že celková energie je nyní 20 kilojoulů na mol. Když se atom s molekulou srazí, potřebují mít dostatek energie. Potřebují dost energie na to, aby rozbili tuto vazbu mezi B a C. Snažíme se tedy rozbít vazbu v tomto místě. Tuto potřebnou energii můžeme vyčíst z našeho grafu. Začínáme na 20 kilojoulech na mol a potřebujeme se dostat sem, na 60. Tolik energie potřebujeme k zahájení reakce. Této energii říkáme energie aktivační a značíme ji E s indexem a. Toto je naše aktivační energie. Aktivační energie je důležitá, neboť je to minimální množství energie potřebné k vyvolání chemické reakce. A v této reakci vidíme, že se potřebujeme dostat na 60 kilojoulů na mol. V tomto bodě je energie na 60 kilojoulech na mol. Začínáme na 20. 60 minus 20 je, samozřejmě, 40. Aktivační energie pro tuto reakci, neboli Eₐ, je, jak vyplývá z našeho grafu, +40 kilojoulů na mol. Takže energie srážky musí být větší nebo rovna aktivační energii. Potom se tady nahoře dostaneme do přechodné struktury. Nakresleme si tedy možnou přechodnou strukturu této reakce. Tvoří se vazba mezi A a B. V tu samou chvíli zaniká vazba mezi B a C. Toto nazýváme přechodnou strukturou, říkáme tomu přechodný stav. Naše struktura se nazývá přechodný stav. Také se tomu říká aktivovaný komplex. Takže přechodný stav, či aktivovaný komplex. Vidíte, že jsem zde nakreslil částečné vazby. Vazba mezi B a C zaniká. V tu samou chvíli vzniká vazba mezi A a B. Pojďme si zde ukázat jednu analogii. Máme kopec. Toto je tedy můj kopec a řekněme, že máme míč. Míč je tady, na této straně kopce. Vytlačit míč nahoru do kopce stojí energii. Dejme tomu, že máme dostatek energie na to dostat míč až sem. V tom případě to není dost na to, aby se míč skutálel z druhé strany kopce. Odtud se míč pouze vrátí zpět do výchozí pozice. Je to stejné, jako když nemáme dost energie při srážce a molekuly se od sebe jen odrazí. Ale pokud máme energie dost a začínáme s míčem tady s dostatkem energie na to, abychom dostali míč až na vrchol kopce, akorát na vršek, pak se míč může skutálet dolů. Pak míč skončí tady, na úpatí kopce. To je stádium, kdy vznikly naše produkty. Produkt bude tedy například nová dvouatomová molekula A-B. Nakreslím to. V tuto chvíli tady máme A-B plus C. To jsou produkty. A toto vyjadřuje jejich energii. Pojďme ji vyčíst z grafu. Produkty máme zde. Jaká energie jim odpovídá? Podíváme se sem a nalezneme hodnotu energie, která je 10. Dejme tomu, že je to 10. Energie produktů je tedy rovna 10 kilojoulům na mol a energie produktů v našem případě je nižší, než energie reaktantů. Začali jsme na 20 kilojoulech na mol a skončili na 10 kilojoulech na mol. Rozdíl energií, změna energie bude tedy energie produktů minus energie reaktantů, což je v tomto případě energie produktů, která je 10 kilojoulů na mol, tedy 10 minus energie reaktantů. Začali jsme s 20 kilojouly na mol. Takže 10 minus 20 nám dá změnu energie, která se rovná -10 kilojoulům na mol. V našem grafu je tedy možno nalézt změnu energie zde. To je změna energie. Toto zde, je záporná změna energie. Píši pak delta E je záporná, což vyjádřím znaménkem minus. Toto je tedy exotermní reakce. Teplo se uvolňuje. Pamatujte si, ničit vazby stojí energii a energie se uvolňuje, když se vazby tvoří. V této reakci se uvolňuje teplo. To také vyjadřuje náš graf pro exotermickou reakci. Pojďme si nyní ukázat jinou reakci. Tady dole máme průběh reakce. Začínáme tady s energií reaktantů Energie našich reaktantů je dejme tomu, 20 kilojoulů na mol. Dále víme, že tento bod vyjadřuje energii aktivovaného komplexu. Tady je tedy náš aktivovaný komplex, který má energii 80 kilojoulech na mol. Rozdíl energie je tedy aktivační energie. Toto je Eₐ. To vyjadřuje naši aktivační energii, která je pro tuto reakci 80 minus 20, což je rovno 60 kilojoulům na mol. Dostali jsme se tedy sem. Do přechodného stavu, do aktivovaného komplexu. Pak toto vyjadřuje energii našich produktů. Tato energie produktů je, pro naši reakci, jak můžeme vidět, větší, než energie reaktantů. Takže přejdeme sem, do 40. Řekněme, že je to na úrovni 40 kilojoulů na mol. Jaká je tady změna energie? Změna energie pro tuto reakci je, ještě jednou, energie produktů minus energie reaktantů, což je 40 kilojoulů na mol. 40 kilojoulů na mol, začali jsme na 20. 40 minus 20 nám dává změnu energie rovnu plus 20 kilojoulům na mol. Takže plus 20 kilojoulů na mol. To je tento rozdíl. Změna energie této reakce je tedy kladná. Tudíž, tento graf vyjadřuje endotermickou reakci. Předchozí příklad byla exotermická reakce, kde se teplo uvolňovalo a toto je endotermická reakce. Endotermická reakce, kde se teplo spotřebovává.

0:00
8:48