Halogenuhlovodíky, substituční a eliminační reakce (14/15) · 9:11
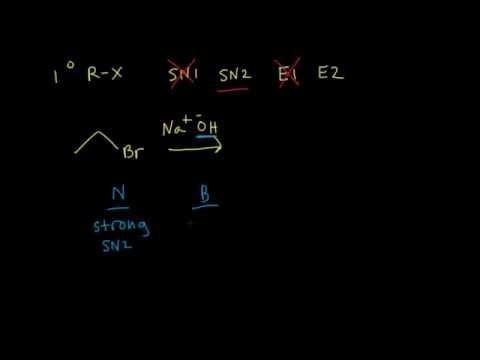
Jak rozpoznat, jestli nastane Sn1, Sn2, E1 nebo E2 Jak máme poznat, zda daný alkylhalogenid bude upřednostňovat substituci nebo eliminaci? A jestli bude mono- nebo bimolekulární? Zde si to ukážeme pro primární a terciální alkylhalogenidy.
Navazuje na
Stereochemii.
0:00
9:11